FA蛋白FANCI在核糖体的生物合成中发挥作用
发布时间:2022-02-17 [返回]
写在前面
今天推荐的是由耶鲁大学医学院团队在2019年2月12日发表于PNAS(IF:9.499,JCR 1区)的一篇文章,通讯作者是SusanJ. Baserga教授,研究表明除了DNA修复功能,FANCI也在核糖体的生物合成中发挥作用。
研究背景
Fanconi贫血(FA)是一种DNA修复疾病,其特征是骨髓衰竭和去除DNA链间交联的能力降低。患有FA的个体通常在儿童早期就出现再生障碍性贫血和先天性异常,包括骨骼、心脏和肾脏缺陷。已知有22种蛋白质可以通过修复DNA链间交联而促进基因组稳定性,FA通路中的一种此类蛋白是FANCI,其在1%FA患者中发生了突变。FANCI及FANCD2一起被称为ID复合物,其通过磷酸化和单泛素化而被激活以进行DNA修复。另外,去泛素化酶USP1介导ID复合物的去泛素化对于DNA修复也很重要。尽管FANCI和FANCD2在DNA修复中以1:1的化学计量比起作用,但FANCI比FANCD2的蛋白水平更高,这引出了一个有趣的问题,多余的FANCI的功能是什么?
真核生物制造核糖体的过程,被称为核糖体生物发生(生物合成),起始于核仁(NO)。除FA外,骨髓功能障碍也是多种核糖体相关疾病的征兆。例如Diamond–Blackfan贫血(DBA)是一种遗传性骨髓衰竭综合征,与大小亚型核糖体蛋白的突变有关。BRCA1(FANCS)最近被证明与RNA聚合酶I(RNAPI)相互作用并调节RNAPI(该酶负责pre-rRNA的转录)。这些研究表明FA与核糖体生物发生缺陷之间可能存在联系。
摘要部分
本研究发现,除了DNA修复,FANCI在核糖体生物发生(核糖体的合成)中也起作用。作者表明,FANCI定位于核仁,在功能和物理上与前核糖体RNA(pre-rRNA)的转录以及大核糖体亚基(LSU)pre-rRNA的加工相联系,且这一过程是独立于FANCD2的。已知FANCI在被激活进行DNA修复时是单泛素化的,但作者发现它在核仁中主要处于去泛素化状态,这需要核质USP1和核仁USP36介导去泛素化。作者的模型表明FA可能存在双重病理生理机制,包括DNA修复缺陷和核糖体生物发生缺陷。
研究内容
1. FANCI是一种核质和核仁蛋白作者从HeLa细胞核提取物中免疫亲和纯化FANCI,并通过质谱鉴定共纯化蛋白。令人惊讶的是,一些肽数最高的蛋白质是核仁蛋白,包括RNA解旋酶和PeBoW复合物的所有成员,这是LSU成熟所需的复合物。通过WB实验,作者确认了PeBoW复合物成员PES1和BOP1与FANCI发生免疫共沉淀。这些表明,FANCI与核糖体生物发生所需蛋白质有所关联,因此作者假设FANCI具有核仁功能。
一系列高通量蛋白质组学的证据表明,FANCI在核仁(NO)中起作用。FANCI被列在HeLa和T细胞的核仁蛋白质组中,这是两种不同的人类细胞。FANCI是两个核仁蛋白质组中唯一的FA蛋白。此外还发现,FANCI与已知的人核仁DUB USP36共聚。
为了检测FANCI对NO的定位程度,作者通过成熟的亚细胞分离技术从HeLa细胞中分离核质(NP)和NO。不同对照组的分析表明,作者分离出的NO纯度很高。亚细胞分离表明FANCI和FANCD2定位于NP和NO。然后作者使用ImageJ定量FANCI和FANCD2的富集。结果表明,相对于NP,FANCI在NO组分中显著富集,而FANCD2在NP和NO中的富集没有显著差异。另外,在NO中,FANCI相对于FANCD2的信号明显更强,这表明FANCI在NO中有独立于FANCD2的作用。
作者对FANCI相关的核仁蛋白PES1进行免疫沉淀,然后通过WB来确认FANCI与核仁蛋白的联系,从而确定FANCI定位于NO。实验显示,在RNA降解条件下,PES1免疫共沉淀FANCI,但FANCD2没有得到同样程度的富集,进一步支持了FANCI在NO中具有独立于FANCD2的作用。此外,由于核酸的降解并没有消除FANCI与PES1的相互作用,因此作者认为这种相互作用不需要大的核酸。
作者还通过免疫荧光法对FANCI和常用的核仁标记蛋白原纤维蛋白(fibrillarin)进行染色。结果发现,fibrillarin染色在NO的致密纤维中心,而且与FANCI共定位。FANCI和fibrillarin共定位的Pearson相关系数在0.47至0.53之间,表明这两种蛋白之间存在适度的正线性关系。
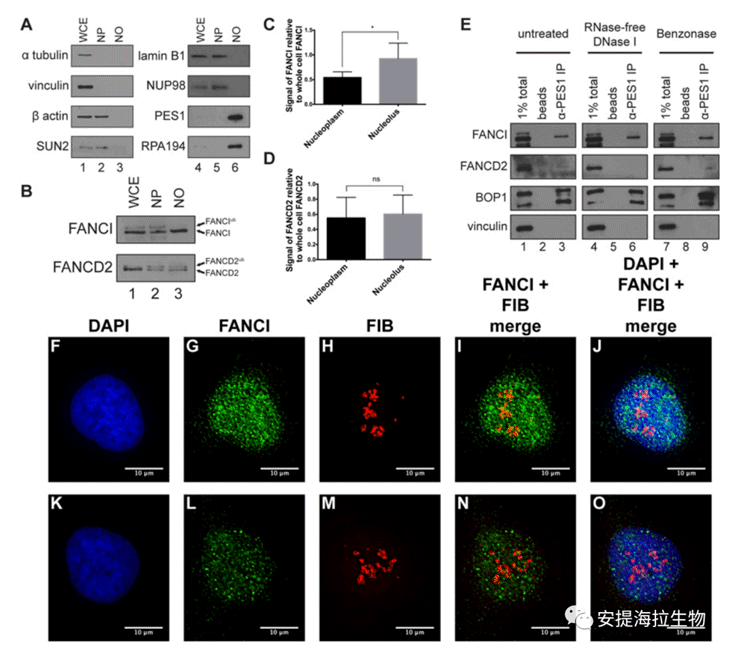
图1. FANCI是一种核仁和核质蛋白
研究结论:除了核质(NP),FANCI在人类细胞中更多地定位于核仁(NO)。FANCI可能具有独立于FANCD2的核仁功能。
2. FANCI在功能和物理上都与Pre-rRNA的转录有关
为验证FANCI在核糖体生物发生中起作用的假说,作者探究了rDNA转录为pre-rRNA是否需要FANCI。作者利用双荧光素酶报告系统来测定RNAPI介导的rRNA转录。研究发现,用一组siRNA或两个独立的siRNA敲低FANCI会降低rDNA转录,然而FANCD2的缺失并不影响rDNA的转录。作者还通过qRT-PCR检测初级pre-rRNA的转录本水平。与荧光素酶测定结果一致,FANCI的缺失降低了初级pre-rRNA的水平,而FANCD2的缺失并未显著改变其水平。因此作者得出结论,FANCI在促进rDNA转录中具有独立于FANCD2的作用。
发现FANCI和RNAPI转录之间有功能上的关联后,作者进一步探究了FANCI是否与RNAPI在物理上相关。IP实验显示,FANCI可与RNAPI大亚基(RPA194)发生免疫共沉淀。双向免疫共沉淀也表明FANCI与RPA194有物理相互作用,而且这种相互作用在HEK293FT、RKO和SH-SY5Y细胞系中是保守的。因此,FANCI通过促进rDNA转录与RNAPI相联系,从而在NO的核糖体生物发生中直接发挥作用。
作者还通过免疫荧光法探究FANCI是否与RPA194共定位。作者观察到了同时包含FANCI和RPA194的独特斑点信号。另外,FANCI和RPA194共定位的Pearson相关系数在0.46到0.74之间,表明这两种蛋白之间具有中等到强的正线性关系,且FANCI定位于核仁。这些结果与FANCI在pre-rRNA转录中的功能一致,其通过与RPA194物理结合定位在NO的原纤维中心。
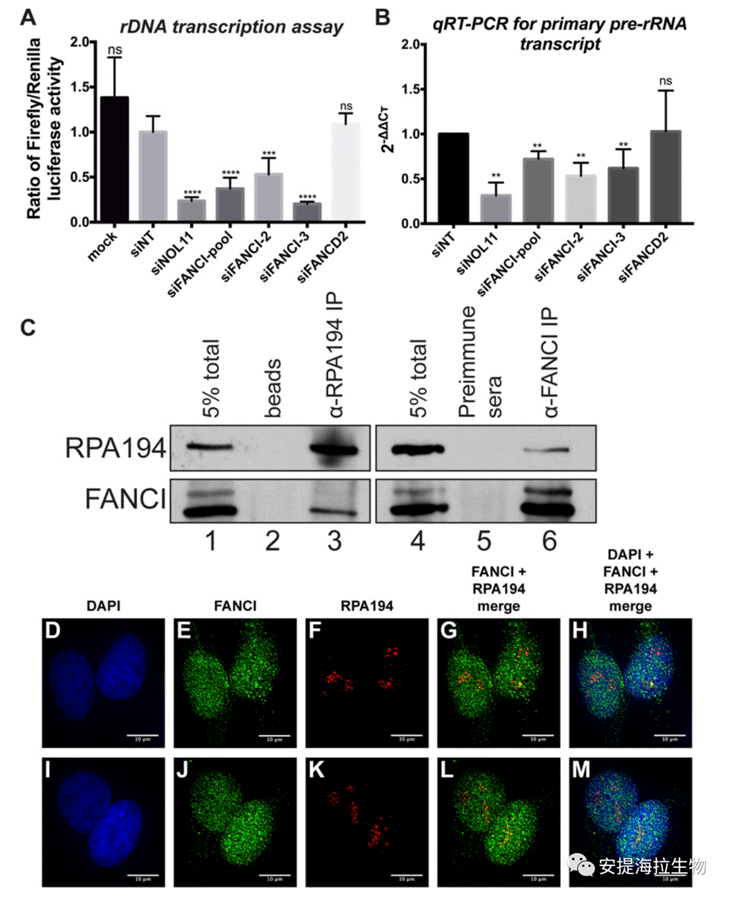
图2. FANCI在物理和功能上与pre-rRNA转录相关
研究结论:FANCI在物理和功能上与RNAPI相联系,其可以促进rDNA的转录,从而在NO的核糖体生物发生中直接起作用。3. FANCI是LSU生物发生和系统翻译所必需的
鉴于FANCI与PES1(LSU生物发生所需的一个因子)在物理上相互作用,作者探究了LSU的pre-rRNA加工是否需要FANCI。LSU的pre-rRNAs包括41S、32S和12S pre-rRNA。实验显示,与对照组相比,FANCI的敲低导致12S pre-rRNA水平显著下降。FANCI缺失的RAMP显示,12S/32S、12S/41S和12S/PTP比值均显著降低。此外,敲低PES1后,这些比值也降低了,且降低程度更大。这表明PES1和FANCI除了物理上相互作用外,在功能上也有联系。与FANCI和PES1不同,NOL11是SSU生物发生过程中的因子,其敲低并没有降低12S/32S、12S/41S和12S/PTP的比值。
通过生物分析仪检测可知,FANCI的敲低导致成熟的28S/18S rRNA比值显著降低。而28S/18S rRNA比值的降低表明LSU的rRNA相对于SSU更少。因此,FANCI是LSU pre-rRNA加工和维持LSU rRNA水平所必需的,这一功能可能是通过与PES1在核糖体生物发生中的直接作用来实现的。
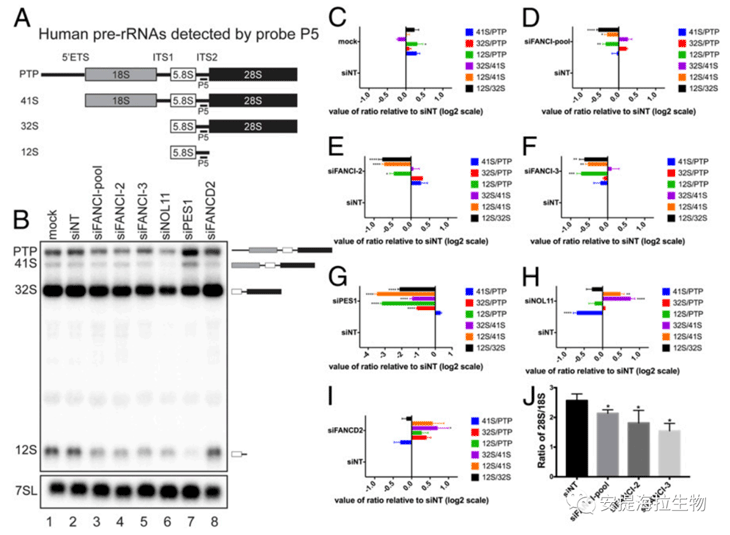
图3. FANCI在LSU的pre-rRNA加工中起作用
由于FANCI在pre-rRNA转录和加工过程中是必需的,作者探究了核糖体的系统蛋白质合成是否也需要FANCI。这个问题特别重要,因为多种其他骨髓衰竭综合征都导致核糖体功能缺陷,包括DBA、Shwachman-Diamond综合征和DC。作者使用了一种用嘌呤霉素标记活细胞中新生多肽的系统。研究发现,FANCI的敲低会导致系统蛋白质合成显著下降。而RPS19(在DBA中突变)、DKC1(在DC中突变)和SBDS(在Shwachman-Diamond综合征中突变)的敲低也显著降低了蛋白质合成水平。研究表明,与其他骨髓衰竭基因一样,FANCI是维持系统蛋白质合成水平所必需的。因此,FANCI的缺失引起pre-rRNA转录和加工缺陷,也导致了核糖体合成蛋白质的最终功能缺陷。
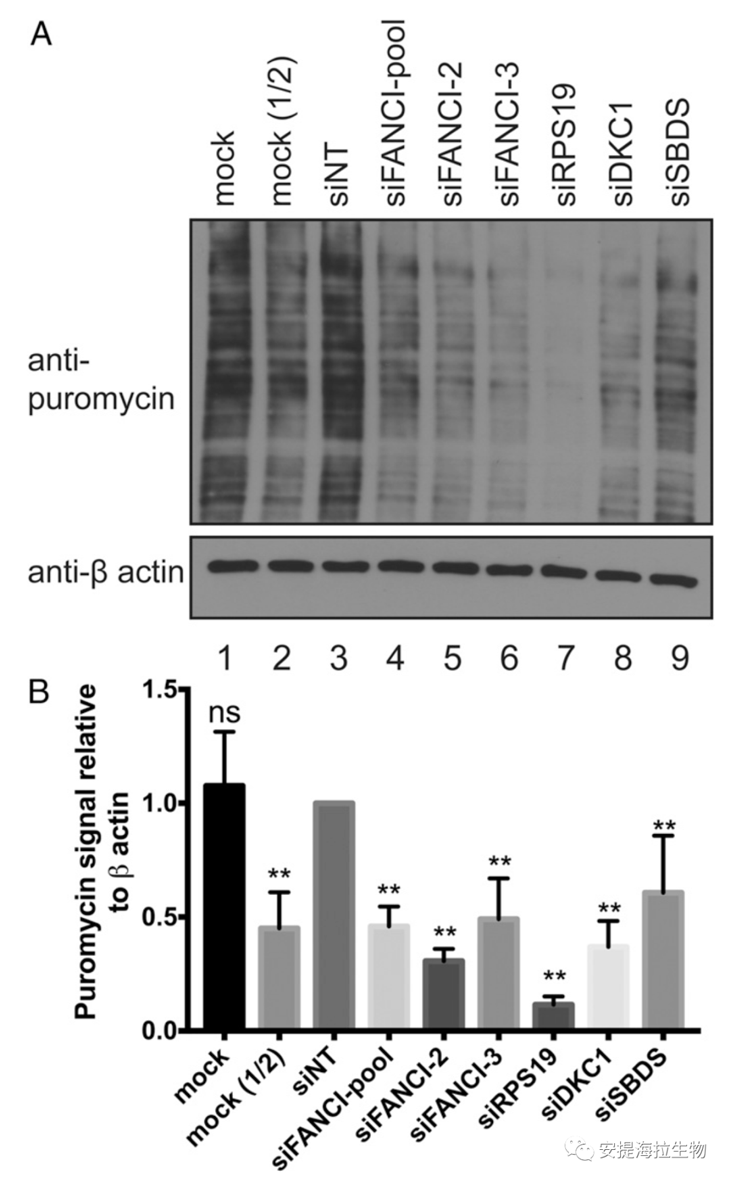
图4. FANCI是核糖体合成系统蛋白质所必需的
研究结论:FANCI的缺失会抑制LSU的pre-rRNA转录和加工,也导致细胞中系统蛋白翻译水平的下降。因此,FANCI在NO中的定位和功能对于核糖体生物发生十分关键,甚至延伸到细胞质的核糖体功能。4. FANCI在核仁中主要处于去泛素化状态
已知FANCI和FANCD2通过单泛素化在DNA修复中被激活。WB实验显示,与核质FANCI相比,更高比例的核仁FANCI处于去泛素化形式。接着作者通过HeLa的亚细胞分离对FANCIub/FANCI的信号进行定量发现,与全细胞或核质FANCI相比,NO中去泛素化FANCI的比例更高。另外,NO中的FANCD2ub/FANCD2与NP相比没有显著差异。故作者得出结论,正常生长条件下,FANCI在核仁中倾向于保持在去泛素化状态。
为进一步验证FANCI在NO中优先处于去泛素化状态,作者诱导了FANCI和FANCD2的单泛素化。结果显示核仁中FANCI仍主要处于去泛素化状态,而核仁中的FANCD2并非如此。因此,在诱导单泛素化的条件下,FANCI在NO中仍主要以去泛素化状态存在,而FANCD2不是。
此外,作者探究了FANCI是否需要单泛素化才能与核仁蛋白结合。作者在表达HA标记的FANCI的细胞中免疫沉淀RPA194,该FANCI具有抑制其单泛素化的K523R错义突变,作者观察到FANCI不需要单泛素化就可以与RNAPI结合。另外,进一步的研究显示,单泛素化和去泛素化的FANCI均与PES1免疫共沉淀,这表明FANCI的单泛素化并不能阻止其与核仁蛋白的结合。
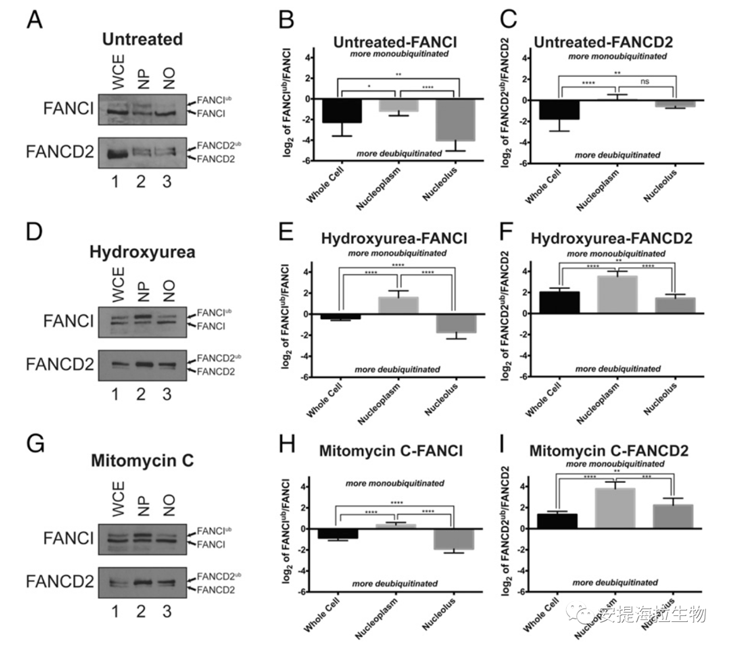
图5. FANCI在NO中主要处于去泛素化状态
研究结论:在核质中进行DNA修复时,FANCI主要处于单泛素化状态,而核仁中的FANCI主要处于去泛素化状态。
5. FANCI在NP和NO间的分布随DNA损伤而变化
由于正常情况下的FANCI倾向于在NO中富集,于是作者探究了DNA损伤是否改变FANCI和FANCD2在NO和NP中的比例。作者用HU或MMC处理细胞,然后对FANCI或FANCD2在核质与核仁中的比例进行定量。结果显示,HU处理后的FANCI或FANCD2在NP与NO中的信号无明显差异。分析表明抑制DNA合成会降低FANCI在核仁中的富集程度。另外,MMC处理细胞会导致FANCI和FANCD2在NP的信号明显强于NO信号,这表明链间交联的形成导致FANCI和FANCD2在NP和NO之间的不同定位。然而,不管是HU还是MMC处理,核质或核仁的FANCI与FANCD2信号之间都没有显著差异。这与FANCI和FANCD2在DNA修复中以1:1化学计量比起作用的理论一致。
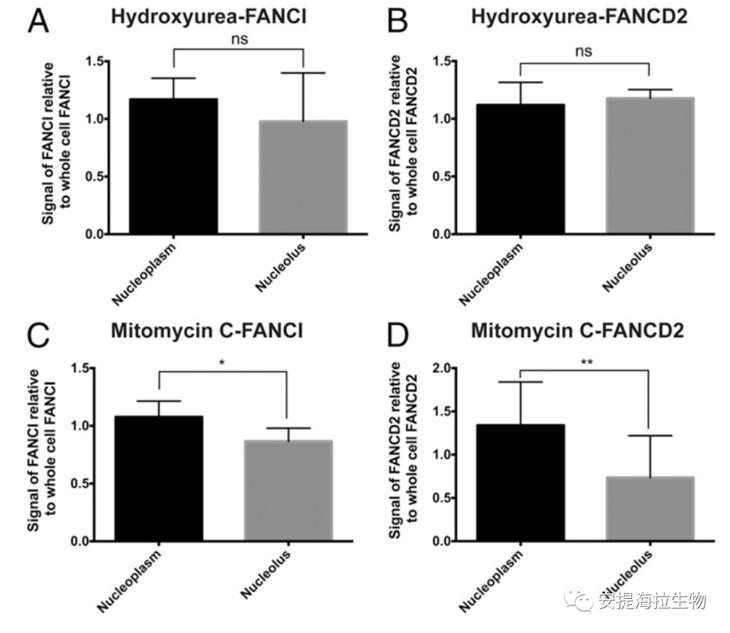
图6. DNA损伤降低FANCI在NO中的富集
研究结论:DNA损伤阻碍了FANCI在核仁中的富集,可能会使FANCI在NP中重新分布,从而发挥其在DNA修复中的作用。
6. FANCI在NO中去泛素化状态的维持需要USP1和USP36
由于FANCI在NO中主要维持在去泛素化状态,因此作者探究了DUBs USP1和USP36的缺失是否会导致核仁中FANCIub/FANCI比值的增加。先前的研究证明USP1是FANCI和FANCD2去泛素化所必需的,并且USP36与FANCI之间有相互作用。已知USP1是一种核质蛋白,而USP36是一种核仁蛋白,则每个蛋白可以在各自的区室调节FANCI的泛素化。WB结果表明,USP1和USP36都在物理上与FANCI结合。因此,作者确认FANCI与USP1和USP36都有关联。
接下来作者进一步探究USP1和USP36是否调节FANCI在NO中的泛素化状态。研究发现,在WCE中,USP1的敲低升高了FANCIub/FANCI的比值,而敲低USP36没有造成FANCIub与FANCI的显著差异。此外,在代表核仁的RPA194免疫沉淀物中,USP1的敲低也增加了FANCIub/FANCI的比值。因此,定位于NP和NO的FANCI均需要USP1介导去泛素化。有趣的是,USP36的敲低也导致核仁的FANCIub/FANCI比值增加约两倍。由此可知,与USP1不同,USP36仅在NO中维持FANCI的去泛素化形式。
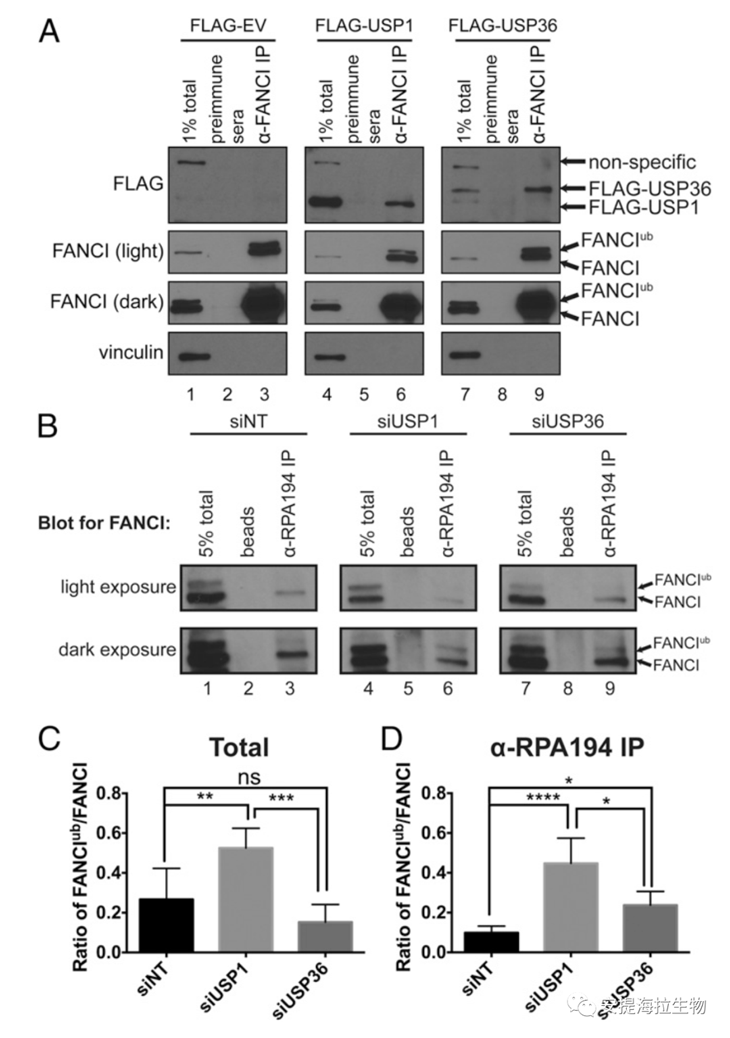
图7. DUBsUSP1和USP36维持核仁中FANCI的去泛素化
研究结论:去泛素化酶USP1和USP36共同工作才能将核仁中的FANCI维持在去泛素化状态。
结论与讨论

Thank you!
Copyright © 厦门安提海拉生物科技有限公司 版权所有 All Rights Reserved.
手机:400-878-2661 邮箱:service@antihela.com 联系人:王先生
技术支持:厦门易尔通网络科技有限公司 闽ICP备15018136号-1 公安备案:
手机:400-878-2661 邮箱:service@antihela.com 联系人:王先生
技术支持:厦门易尔通网络科技有限公司 闽ICP备15018136号-1 公安备案:












