USP2通过拮抗E3-泛素连接酶IDOL调控LDLR信号通路
发布时间:2022-02-18 [返回]
写在前面
今天推荐的是由荷兰阿姆斯特丹大学学术医学中心团队在2016年2月5日发表于Circulation Research(IF:15.180,JCR 1区)的一篇文章,通讯作者是Noam Zelcer教授,研究表明USP2能够促进LDLR的去泛素化并抑制其降解。
研究背景
低密度脂蛋白(LDL)受体(LDLR)是LDL-胆固醇循环的中心调节因子。LDLR突变是高胆固醇血症发生的主要原因,这是一种以肝脏LDL清除减少、血浆胆固醇水平升高和动脉粥样硬化加速为特征的疾病。由于其在脂蛋白代谢中的关键作用,LDLR的水平受到严格调控。最近的研究表明,IDOL是LDLR丰度和LDL-胆固醇循环水平的调节因子。作为E3-泛素连接酶,IDOL促进LDLR的泛素化和随后的溶酶体降解。因此,抑制IDOL介导的LDLR降解是提高肝脏LDL-胆固醇清除的潜在策略。
摘要部分
作者利用遗传筛选确定了泛素特异性蛋白酶2(USP2)是IDOL介导的LDLR降解的转录后调控因子。作者发现,USP2的两个亚型USP2-69和USP2-45与IDOL相互作用并促进其去泛素化。IDOL的去泛素化需要USP2的酶活性以维持IDOL蛋白稳定。矛盾的是,这也显著降低了IDOL介导的LDLR降解和IDOL限制LDL进入细胞的能力。相反,USP2的缺失以IDOL依赖的方式降低了LDLR水平,并限制LDL的摄取。作者发现了一个包含IDOL、USP2和LDLR的复合物,并证明在此背景下USP2促进LDLR的去泛素化并阻止其降解。
研究内容
1. USP2是IDOL的新型结合伴侣蛋白
作者通过酵母双杂交技术寻找与IDOL或LDLR相互作用的去泛素化酶。结果发现USP2-69亚型可以与全长IDOL相互作用。分析表明,IDOL的F3和连接肽亚结构域是其与USP2相互作用所需的最小区域。此外,IDOL的RING突变体IDOLC387A仍可以与USP2相互作用。该突变体不能促进LDLR降解和IDOL的自泛素化,表明这两种功能对USP2和IDOL的相互作用不是必需的。
作者接下来证实了这种相互作用也发生在哺乳动物细胞(HEK293T)中。免疫沉淀实验显示USP2和IDOL有物理上的相互作用。这种相互作用与USP2s的催化活性无关,因为无催化活性的突变体USP2C276A还能与IDOL相互作用。作者还发现了USP2的一种较短亚型USP2-45也与IDOL相互作用。
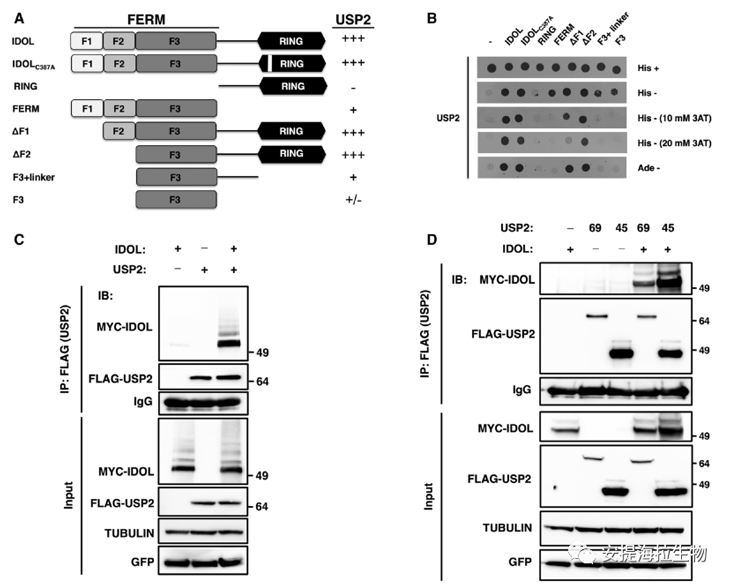
图1. USP2是IDOL的新型结合伴侣分子
研究结论:USP2是IDOL的新型结合伴侣分子,也是IDOL-LDLR信号轴的潜在调节因子。
2. USP2去泛素化IDOL并使其稳定
作者发现过表达USP2可以显著提高IDOL蛋白的稳定性。尽管IDOL与野生型USP2、USP2C276A都有相互作用,但只有活性形式的USP2可以提高IDOL的水平。因此IDOL的稳定需要USP2的去泛素酶活性。
IDOL是一种高度不稳定的蛋白质,这可能是由于其具有自泛素化活性。实验发现,USP2稳定IDOL是IDOL半衰期延长的结果。然后作者使用药物阻断蛋白酶体降解,这种处理稳定了IDOL水平并促进泛素化的IDOL积累。在这种情况下,两种USP2亚型都降低了泛素化的IDOL水平。作者还观察到USP2在细胞中的有效沉默导致IDOL蛋白水平下降。这些表明USP2可以通过去除IDOL上的泛素以防止其降解。
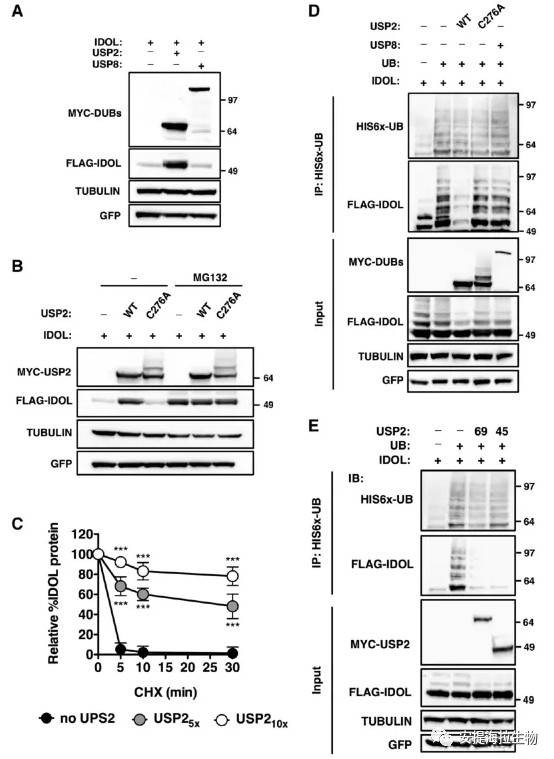
图2. USP2介导IDOL的去泛素化并增加其稳定性
研究结论:USP2功能的获得和缺失均会影响IDOL蛋白的水平,即USP2调控IDOL的水平。
3. USP2抑制IDOL介导的LDLR降解
鉴于前面的实验发现IDOL的丰度增加,作者推测USP2促进LDLR的降解。然而作者观察到相反的结果,USP2(−69和−45)以剂量和活性依赖的方式抑制了LDLR与极低密度脂蛋白受体(IDOL的第二个靶点)的降解。此外,IDOL是LXR的一个转录靶点,作者还探究了USP2是否可以抵消LXR对LDLR的影响。结果发现,USP2也能够抑制LXR诱导的LDLR降解。
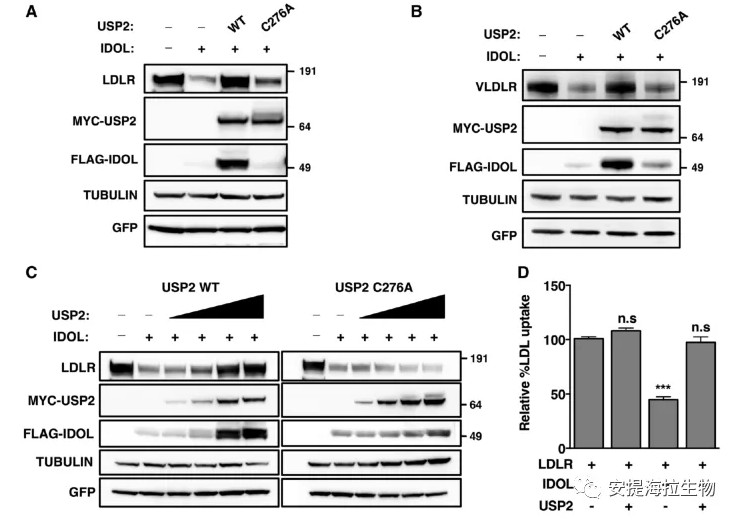
图3. USP2阻碍IDOL介导的脂蛋白受体降解
研究结论:USP2对IDOL活性的拮抗作用抵消了IDOL降低细胞LDL摄取的影响,因此USP2被认为是脂蛋白摄取的潜在调控因子。
4. 沉默USP2促进LDLR以IDOL依赖的方式降解
沉默USP2会导致细胞中LDLR的蛋白水平显著降低,但未改变其mRNA水平。作者利用3个单独的USP2 siRNA有效地抑制了HepG2细胞中USP2的表达,并降低了LDLR的蛋白水平。与IDOL靶向质膜上的LDLR一致,作者发现USP2的沉默明显导致LDLR从细胞表面移除,并因此减弱了不同类型细胞对LDL的摄取。
在确定USP2影响LDLR蛋白的水平后,作者继续探究这个机制是否需要IDOL的活性。作者在野生型或Idol(-/-)的MEFs中沉默USP2,结果显示野生型细胞中USP2的沉默降低了LDLR的蛋白水平。然而,Idol(−/−)细胞中的LDLR蛋白水平升高,且其对USP2的沉默并不敏感。
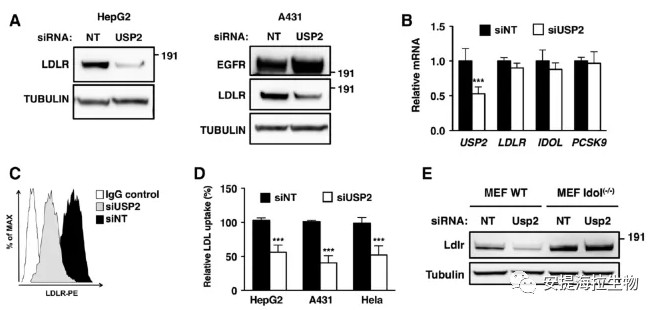
图4. USP2的沉默促进LDLR以IDOL依赖性的方式降解
研究结论:USP2–IDOL之间的联系在控制LDLR蛋白水平的功能上具有重要意义。5. IDOL、USP2和LDLR形成一个功能性的三元复合物来调节LDLR的泛素化和降解
首先作者探究了USP2水平的提高是否能独立于IDOL影响外源过表达的LDLR水平。作者以逐渐增加的剂量将USP2引入细胞,结果发现LDLR的蛋白水平没有受到影响,这与IDOL存在时观察到的不同。实验表明USP2调节LDLR水平需要IDOL介导的受体泛素化。
然后作者发现USP2可以与哺乳动物细胞中的LDLR相互作用,尽管作用较弱。进一步研究发现,IDOL的FERM结构域与LDLR相互作用。此外,当IDOL、USP2和LDLR都被引入细胞后,作者发现USP2和IDOL都很容易与LDLR共沉淀。这说明质膜上很可能形成了IDOL、USP2和LDLR的三元复合物。实验显示,Epsin1和USP2都能抑制LDLR的IDOL依赖性降解。Epsin1增加了泛素化的LDLR,而USP2显著降低了泛素化的LDLR水平。
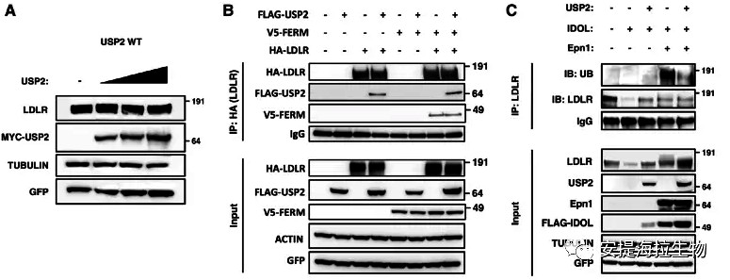
图5. IDOL、USP2和LDLR形成一个功能性三元复合物从而调节LDLR的泛素化和降解
研究结论:USP2可以抑制LDLR的IDOL依赖性泛素化,从而防止受体被导向溶酶体发生降解。
结论与讨论

Thank you!
Copyright © 厦门安提海拉生物科技有限公司 版权所有 All Rights Reserved.
手机:400-878-2661 邮箱:service@antihela.com 联系人:王先生
技术支持:厦门易尔通网络科技有限公司 闽ICP备15018136号-1 公安备案:
手机:400-878-2661 邮箱:service@antihela.com 联系人:王先生
技术支持:厦门易尔通网络科技有限公司 闽ICP备15018136号-1 公安备案:












