USP7通过促进Axin的稳定抑制Wnt/β-catenin信号传导
发布时间:2022-02-18 [返回]写在前面
研究背景
摘要部分
研究内容
接下来,作者试图确定USP7的过表达是否影响Wnt/β-catenin信号传导。相比对照组,USP7(WT)的异位表达强烈抑制Wnt3a诱导的STF报告基因和β-连环蛋白的积累。USP7 C223A突变体的异位表达则略微增加了Wnt3a诱导的STF报告基因。此外,作者通过将野生型USP7和C223A突变体重新引入USP7基因敲除的HEK293T STF-GFP细胞中进行了回补实验。USP7敲除细胞表达高水平的STF-GFP,其被野生型USP7强烈抑制,但未被C223A突变体抑制。
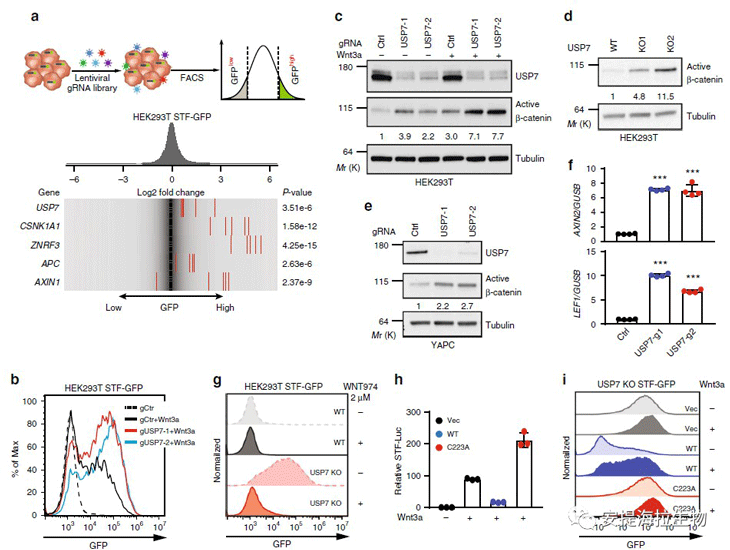
图1. USP7是Wnt/β-catenin信号转导的有效负调节器
接下来作者作者使用STF-Luc测定法和Cell Titer-Glo(CTG)测定法以剂量反应方式测量了各种USP7抑制剂对Wnt/β-catenin信号传导和细胞增殖的影响。所有新一代USP7抑制剂,包括Almac430,Almac4732,P5042931,FT67129和GNE-677633,均增加了STF报告基因。Almac4和Almac47具有最强的Wnt刺激活性。在所有测试浓度下,两种化合物均不影响HEK293T USP7 KO细胞的增殖,这表明Almac4和Almac47的脱靶活性最低。这些数据共同表明,USP7的药理学抑制作用增强了不同细胞系中的Wnt/β-catenin信号传导。
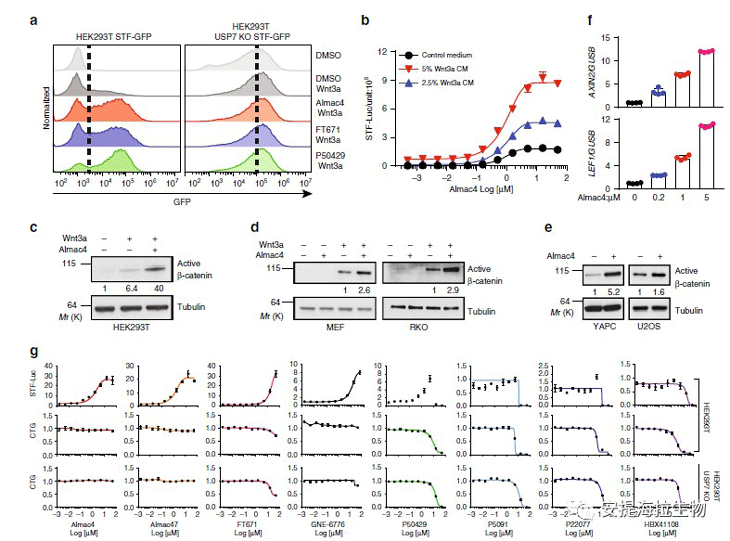
图2. USP7抑制剂可增强Wnt/β-catenin信号传导
由于USP7通过促进其去泛素作用来稳定其底物,因此作者研究了USP7是否会影响Axin的泛素化。研究发现,野生型USP7的过表达降低了异位表达的Axin1的多聚泛素化作用。接下来,作者通过体外去泛素化试验证实了Axin是USP7的直接底物。不仅如此,研究结果表明USP7的过表达抑制了RNF146或SIAH1诱导的Axin的多聚泛素化。
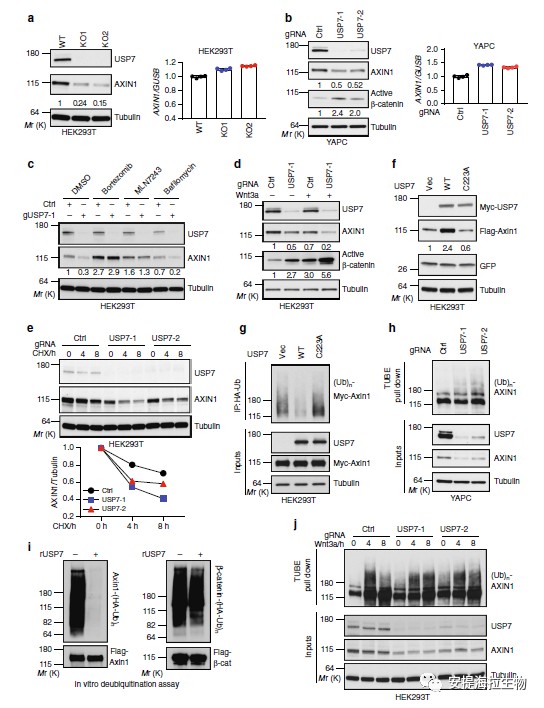
图3 USP7促进Axin的去泛素化和稳定化
USP7在Axin1串联亲和力蛋白质纯化质谱筛查系统中获得了成功。接下来,作者检查了USP7的哪个域负责Axin相互作用。USP7包含三个主要结构域,包括一个氨基末端肿瘤坏死相关因子样(TRAF)结构域,一个中间催化结构域和一个羧基末端串联UBL结构域(TUD),其中包含五个泛素样折叠。如图4d所示,Axin1与USP7的TRAF结构域(而非TUD结构域)共免疫沉淀。实验结果表明,USP7的TRAF域与AXIN1和AXIN2相互作用的方式类似于与其他USP7底物的结合方式。
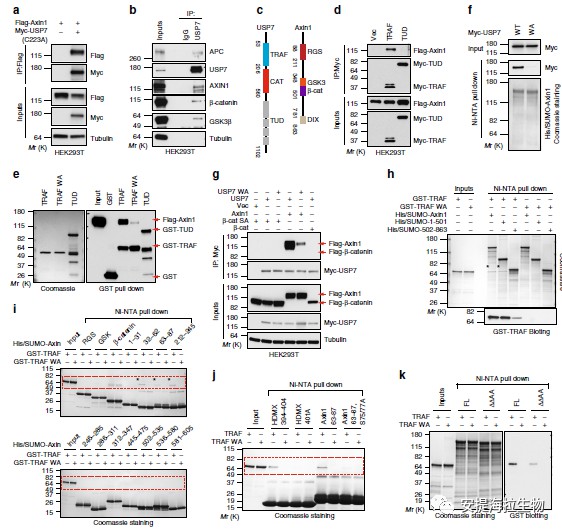
图4 USP7通过其TRAF结构域直接与Axin结合
由于USP7负调控Wnt信号,作者研究了USP7在小鼠多能间充质干细胞C3H10T1/2和小鼠骨髓基质细胞ST2中成骨细胞分化中的功能。Almac4的处理增强了C3H10T1/2和ST2细胞中Wn3a诱导的碱性磷酸酶染色。同样的,Almac4增加了C3H10T1/2和ST2细胞中Wnt3a诱导的碱性磷酸酶(Alpl)和β-catenin靶基因Axin2和Lef1的mRNA水平。接下来,作者进一步实验发现,ODM增加了C3H10T1/2细胞中活性β-catenin的水平,而USP7抑制剂Almac4进一步增强了该活性。在存在ODM的情况下,C3H10T1/2和ST2细胞中USP7的基因敲除或药理抑制作用增加了碱性磷酸酶染色和Alpl和β-catenin靶基因的mRNA表达。
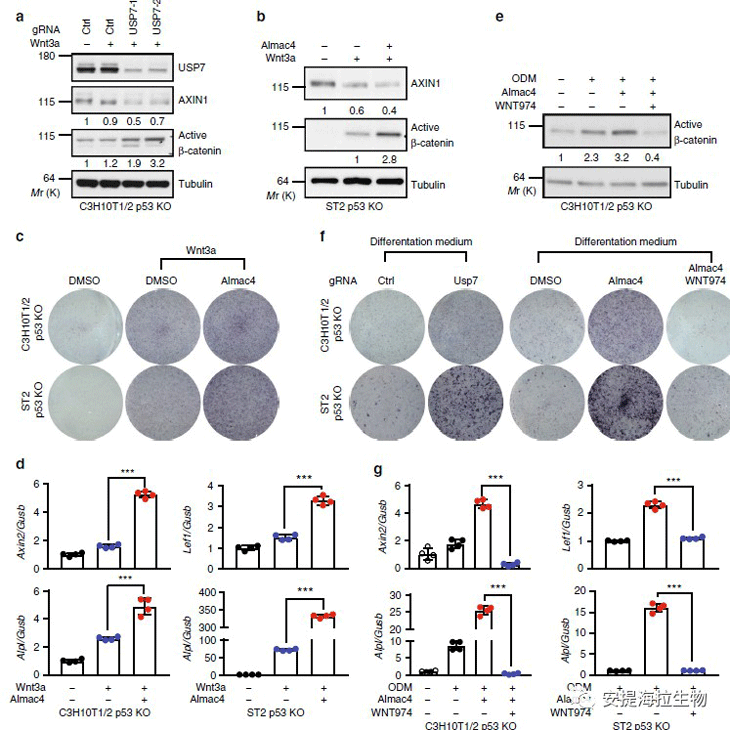
图5. USP7抑制Wnt诱导的成骨细胞分化
众所周知,Wnt/β-catenin信号传导抑制脂肪细胞分化。作者研究了USP7在使用小鼠前脂肪细胞细胞系3T3-L149的脂肪细胞分化中的作用。与C3H10T1/2和ST2不同, 3P3-L1的增殖不受USP7抑制。使用独立的gRNA敲除Usp7增强了Wnt3a诱导的活性β-连环蛋白的积累。USP7抑制剂Almac4的治疗也增加了活性β-catenin的积累。这些结果表明,USP7抑制3T3-L1细胞中的Wnt/β-catenin信号传导。接下来,作者研究了USP7在用脂肪细胞分化培养基处理过的3T3-L1细胞中β-catenin信号传导中的作用。与先前的发现一致,脂肪细胞分化培养基降低了3T3-L1细胞中胞质β-catenin的水平。这些结果表明,USP7敲除增加了用脂肪细胞分化培养基处理的细胞中的Wnt/β-catenin信号传导。与Wnt/β-catenin信号传导阻滞脂肪细胞分化的观点一致,USP7敲除强烈抑制脂肪细胞分化介质诱导的脂滴形成和成脂标记物的表达。
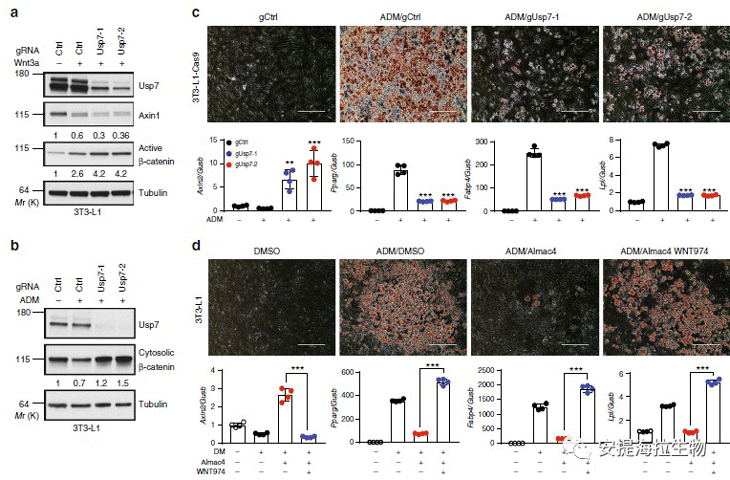
图6. USP7通过抑制Wnt信号传导促进脂肪细胞分化
研究结论:USP7抑制主要通过激活Wnt信号传导来阻止脂肪细胞分化。
结论与讨论

手机:400-878-2661 邮箱:service@antihela.com 联系人:王先生
技术支持:厦门易尔通网络科技有限公司 闽ICP备15018136号-1 公安备案:












